De eigenschappen van water: isotopen en moleculaire structuur.
De eigenschappen van water 1: algemeen
De eigenschappen van water 2: fysische en chemische eigenschappen
Isotopensamenstelling van water
Water is een mengsel van verschillende combinaties van zuurstof- en waterstofisotopen die van elkaar verschillen in het aantal neutronen dat geassocieerd is met de protonen in de kern.
1H,2 H (Deuterium)3H (Tritium)
16O, 17O,18O.
De isotopische verhoudingen zijn als volgt:
Voor waterstof:
2H/1H = 1 / 6900
3H/1H = 1 / 10 18
Tritium is een onstabiel element, de halfwaardetijd is 12,5 jaar.
Voor zuurstof:
18O/16O = 1 / 500
17O/16O = 1 / 2500
De belangrijkste 4 moleculaire soorten en hun frequenties zijn als volgt:
1H216O = 99,7%
1H2 18 O = 0,2%
1H217O = 0,04%
1HD16O = 0,03%
D216O = erg zwak
De verschillende isotopen veroorzaken verschillen in de fysische eigenschappen van de moleculen, in het bijzonder hun dichtheid, maar de chemische eigenschappen blijven hetzelfde.
Zwaar water D2O bestaat in zijn natuurlijke staat maar in zeer
laag. Om een aanzienlijke hoeveelheid te hebben, is het noodzakelijk om de technieken van isotopenscheiding onder de knie te krijgen: dit was een van de fundamentele uitdagingen tijdens de laatste wereldoorlog om het atoomwapen voor te bereiden.
De isotopensamenstelling van de chemische componenten van water wordt gebruikt bij de schatting van thermodynamische parameters zoals temperatuur;
het rapport 18 O/16O ijs van de poolkappen en water uit fossiel grondwater geeft informatie over het klimaat van vroeger.
Verdamping van oceaanwater vindt plaats bij isotopenfractionering: de lichte isotoop van zuurstof wordt bij voorkeur verdampt tot de zware isotoop. De oceanen zijn rijker aan zware isotopen dan water uit wolken en neerslag.
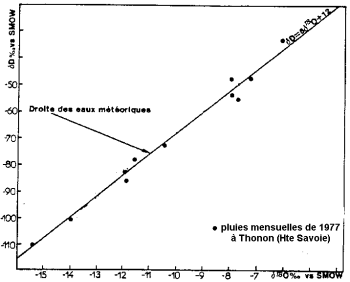
Stabiel isotoopgehalte van neerslag (naar Blavoux en Letolle, 1995).
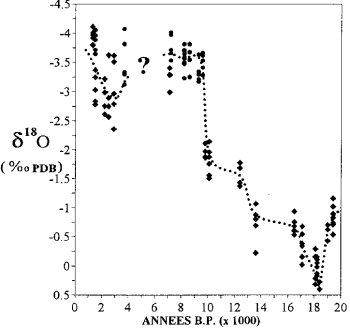
Variatie in het zuurstofisotoopgehalte in koralen in Mayotte (naar Casanova et al., 1994).
Structuur van het molecuul
Waterstof- en zuurstofatomen bundelen hun elektronen om een complete laag te vormen zoals die van neon. Inderdaad, het zuurstofatoom mist 2 elektronen om zijn elektronische schaal te voltooien, het zijn de 2 waterstofatomen die het leveren. Het gevormde H2O-molecuul is stabiel.
Zuurstof: 8-protonen + 8-neutronen
Waterstof: 2 (2 * (1 proton + 1 neutron))
Totaal: 10-protonen die de ladingen van 10-elektronen in evenwicht houden.
De waterstofkernen hebben één kant van die van zuurstof om een karakteristiek 'Mickey's hoofd' te vormen (de waterstof zijn de oren).
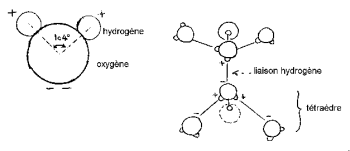
De HOH-hoek is 104,474 ° (kenmerkend voor tetraëdrische geometrie). De afstand tussen zuurstof en waterstofatoom is dicht bij 1 A ° (0,95718 A °) in damp. De effectieve diameter van het molecuul is in de orde van grootte van 2,82 A °.
Elektrische ladingen zijn ongelijk verdeeld in dit kleine molecuul. Elektronen worden sterker aangetrokken door het zuurstofatoom dan door het waterstofatoom. Er zijn 2 centra van positieve ladingen nabij de waterstofkernen en 2 centra van negatieve ladingen nabij de zuurstofkern. Deze onbalans in de verdeling van ladingen, gecombineerd met de niet-lineaire geometrie van het watermolecuul, manifesteert zich in het bestaan van een sterk elektrisch dipoolmoment. Het watermolecuul is polair; het gedraagt zich als een elektrische dipool die zich zo kan binden met andere polaire moleculen. Watermoleculen kunnen inderdaad tussen de samenstellende ionen van een kristal worden ingevoegd door hun deel van de tegengestelde elektrische lading daarop te richten. De aantrekking van kristallijne ionen wordt sterk verzwakt en de cohesie van het kristal wordt verminderd, wat het oplossen ervan vergemakkelijkt. De polaire eigenschappen van het watermolecuul verklaren de techniek van microgolfverwarming. In feite oriënteert een gepolariseerd molecuul zichzelf ten opzichte van een elektrisch veld; als dit varieert, volgt het molecuul de oriëntatieverandering. Vanaf een bepaalde frequentie, een paar GHz voor water, produceren de bewegingen van moleculen warmte door wrijving. Huishoudelijke ovens werken doorgaans met een frequentie van 2,45 GHz, wat UHF is.
De 3 kernen van het molecuul staan niet stil, ze bewegen ten opzichte van elkaar, het molecuul trilt en draait. In vloeibaar water hebben moleculen de neiging om te associëren: Mickey's hoofden binden oor aan kin door waterstofbinding. Inderdaad, van de 8 perifere elektronen van zuurstof zijn er slechts 4 betrokken bij covalente bindingen met waterstofatomen. De overige 4 elektronen zijn gegroepeerd in 2 paren, vrije elektronendoubletten genaamd. Elk van deze negatief elektrisch geladen doubletten kan een elektrostatische binding vormen met een positief geladen waterstofatoom van een nabijgelegen watermolecuul. De waterstofbrug, die stabiel is bij kamertemperatuur, is niettemin kwetsbaar in vergelijking met de covalente binding. In het watermolecuul ligt de geometrie die wordt gevormd door de richting van de 2 covalente bindingen en de 2 vrije elektronische doubletten dicht bij die van een tetraëder waarvan het centrum wordt ingenomen door de zuurstofkernen.
De grootschalige structuur van het watermolecuul is echter nog onvoldoende bekend. De röntgen- en neutronendiffractiespectra leveren 2 hoofdwaarden op: een signaal dat overeenkomt met 1 A °, de afstand tussen de waterstof- en zuurstofkernen en een waarde van 2,84 tot 4 A °, variërend naargelang de temperatuur en overeenkomend met de afstand tussen 2 zuurstofkernen. Röntgendiffractometrie maakt het ook mogelijk om het gemiddelde aantal moleculen per volume-eenheid vloeistof te kennen op een afstand R van een bepaald molecuul. Een watermolecuul heeft gemiddeld 4,4 buren, wat duidt op een tetraëdrische mesh. Naast moleculen die zijn verbonden door waterstofbruggen, zijn er andere ongebonden moleculen, wat kan verklaren waarom het aantal naburige moleculen iets groter is dan 4, en niet precies 4 zoals vereist door een strikt tetraëdrische gekristalliseerde toestand. Het kristalrooster van moleculen verbonden door waterstofbruggen zou holtes vormen waar ongebonden moleculen zouden worden gehuisvest. Een andere hypothese is gebaseerd op de vervorming van waterstofbruggen. De laatste, oorspronkelijk lineair, dat wil zeggen met de O-HO-atomen uitgelijnd, zou in verschillende mate kunnen draaien en moleculen die verder weg zijn dan de naaste buren, het centrale molecuul kunnen benaderen.
Met krachtige computers zijn recentelijk theoretische modellen ontwikkeld. Ze geven aan dat ongeveer 80% van de watermoleculen betrokken zijn bij 3 of 4 waterstofbruggen; aan de andere kant sluiten ze de aanwezigheid van ongebonden moleculen uit. Computermodellering suggereert dat naarmate het water afkoelt, de netwerken van moleculen steeds meer lijken op zeshoeken die lijken op die in ijs.
De vaste toestand komt overeen met een striktere kristallijne opstelling. Bij normale druk heeft ijs een hexagonale structuur. Bij lage temperatuur (onder -80 ° C) kan het een kubische structuur aannemen. Elektrische ladingen kunnen in het kristalrooster bewegen en ionische kristaldefecten produceren: gehydrateerd proton H3O + en hydroxylion OH-. Het kristalrooster van ijs komt niet overeen met de meest compacte mogelijke stapeling van moleculen. Bij fusie storten de defecten in doordat de waterstofbruggen breken en de moleculen dichter bij elkaar komen: de dichtheid neemt toe tot een maximum bij 4 ° C. Vervolgens, in vloeibaar water, duwt de temperatuurstijging de moleculen uit elkaar en neemt de dichtheid af.
Meer weten, referenties en bibliografie:
Blavoux B. en Letolle R. (1995) - Bijdrage van isotooptechnieken aan de kennis van grondwater. Geochronics, 54, p. 12-15.
Caro P. (1990) - De fysische en chemische eigenschappen van water. Het grote boek met water, La Villette, p. 183-194.
Eagland D. (1990) - De structuur van water. La Recherche, 221, blz. 548-552.
Maidment DR (1992) - Handbook of hydrogeology. Mc Graw Hill.
Casanova J., Colonna M. en Djerroud K. (1994) - Geoprospectief - paleoklimatologie. Rapp. scient. BRGM, blz. 76-79.

